Hämatologie, Onkologie und Palliativmedizin
Unser Leistungsspektrum im Überblick
Das Team unserer Klinik ist auf die Diagnostik und Therapie von gut- und bösartigen Bluterkrankungen (Hämatologie), bösartigen Tumoren (Onkologie) sowie Gerinnungserkrankungen (Hämostaseologie) spezialisiert.
Diagnostik
Die hämatologische und onkologische Diagnostik umfasst ein breites Spektrum zum Teil aufeinander aufbauender Untersuchungen und Methoden, von denen einige auch direkt am Patientenbett durchgeführt werden können.
Die Blutuntersuchung ist eine der wichtigsten diagnostischen Verfahren und kann Hinweise auf verschiedene Erkrankungen geben. Das Blutbild liefert Informationen über die mengenmäßige Zusammensetzung des Blutes bzw. seiner festen Bestandteile (z.B. über die Anzahl an roten Blutkörperchen (Erythrozyten), weißen Blutkörperchen (Leukozyten) oder der Blutplättchen (Thrombozyten)).
Im Differentialblutbild (großes Blutbild) hingegen werden die Unterarten der weißen Blutkörperchen betrachtet und unterschieden („differenziert“): Granulozyten (Basophile, Neutrophile, Eosinophile), Lymphozyten, Monozyten/Makrophagen (Fresszellen). Die weißen Blutkörperchen sind ein wichtiger Teil unseres Immunsystems. Anzahl und Verteilung der einzelnen Unterarten können Hinweise auf bestimmte Krankheiten geben.
Diagnostik und Therapie von Krebserkrankungen sind ohne Bildgebung nicht denkbar, aber auch in der Verlaufskontrolle und Tumornachsorge spielen diese Untersuchungen eine zentrale Rolle. Ultraschall (Sonographie) ist eine in der Medizin häufig genutzte und primär orientierende Untersuchungsmethode. Das „klassische“ Röntgen verliert zunehmend an Bedeutung, da an dieser Stelle die Computertomographie (CT) und die Magnetresonanztomographie (MRT) wichtige Informationen über Größe und Gewebeeigenschaften wie Zelldichte und Gefäßversorgung geben können. Für sehr bestimmte Fragestellungen wird ergänzend das PET/CT (siehe Spezielle Diagnostik) angewendet, welches eine noch genauere Auskunft geben kann.
Knochenmark ist das Ursprungsgewebe der Blutbildung. Es wird meist aus dem Beckenknochen (Beckenkammbiopsie) unter örtlicher Betäubung entnommen, unter dem Mikroskop begutachtet (zytomorphologische Diagnostik) und für weitere Untersuchungen (histopathologische, immunologische, zytogenetische und molekulargenetische Analysen) an das Zentrallabor, an die Pathologie oder an weitere Speziallabore versendet.
Bei der Liquorpunktion (umgangssprachlich auch Lumbalpunktion) wird das sogenannte „Nervenwasser“ (Fachbegriff: Liquor) gewonnen. Es befindet sich innerhalb der Wirbelsäule und kann zwischen den Wirbelkörpern in Höhe der Lendenwirbelsäule mit einer dünnen Nadel (Punktion) zur weiteren Diagnostik entnommen werden.
Bei einer Pleurapunktion wird angesammelte Flüssigkeit (Pleuraerguss) aus dem kleinen Zwischenraum zwischen Lungen- und Rippenfell (Pleurahöhle) entfernt oder auch für weitere Untersuchungen ihrer Bestandteile entnommen.
Bei einer Ascitespunktion wird analog Flüssigkeit aus der Bauchhöhle zur Feststellung der Krankheitsursache (diagnostische Punktion) oder bei großen Volumina zur Entlastung des Bauchraums (therapeutische Punktion) entnommen.
Spezielle Diagnostik

Markus Scholz
Das Probenmaterial wird unter anderem mit speziellen blauen und roten Farbstoffen angefärbt und unter dem Mikroskop hinsichtlich Aussehen und Anzahl der Bestandteile begutachtet. Die verschiedenen Zellen (z.B. „gesunde“ und „kranke“ Zellen) können anhand der unterschiedlichen Bindung der Farbstoffe sowie vieler anderer Kriterien voneinander unterschieden werden.
Die Immunhistochemie ergänzt die konventionelle histomorphologische Diagnostik. Das bedeutet, dass die Zellen und Strukturen im Gewebe unter dem Mikroskop durch spezielle Färbemethoden (z.B. Antikörper) gezielt und besser sichtbar gemacht werden.
Die Immunphänotypisierung ordnet verschiedenen Bestandteilen von Blut und Knochenmark aber auch anderen Körperflüssigkeiten wie Liquor oder Pleuraerguss einen spezifischen „Steckbrief“, der sie genau charakterisiert, zu. Diese Erkennung ist anhand des Oberflächenprofils (Antigenprofils) möglich, die auch bei Krebszellen sichtbar sind. So kann deren Linienzugehörigkeit (myeloische vs. lymphatische Reihe) erfolgen. Außerdem wird der Differenzierungsgrad, das heißt wie stark die Zellen in ihrer Struktur vom Ausgangsgewebe abweichen, bestimmt. Diese Methode erlaubt zum einen eine sehr spezifische Diagnostik der verschiedenen Bluterkrankungen wie Lymphome und Leukämien, kanalisiert spezifische Therapieentscheidungen und ermöglicht Aussagen über den Krankheitsverlauf.
Die zytogenetische Untersuchung ist ein wesentlicher Bestandteil in der Diagnostik von hämatologischen Erkrankungen. Dabei werden die Chromosomen (das Erbgut in den Zellen) unter dem Lichtmikroskop betrachtet. Genetische Veränderungen dienen vor allem zur Sicherung der Diagnose und beeinflussen die Prognoseeinschätzung/Risikostratifikation, Therapieplanung und Therapiekontrolle.
Die molekulargenetische Diagnostik ist zum Nachweis oder Ausschluss von krankheitsverursachenden Veränderungen (Mutationen) in den einzelnen Genen bedeutsam. Die Ergebnisse einer solchen Untersuchung ermöglichen eine individuelle auf die Patientin / den Patienten zugeschnittene Therapieplanung, deshalb spricht man auch von personalisierter Krebsmedizin oder Präzisionsonkologie.
In der Präzisionsonkologie stehen uns verschiedene Technologien wie die Hochdurchsatz-Sequenziertechnologie (next generation sequencing, NGS) zur Verfügung. Die NGS ist zum Beispiel bei der Therapie des Lungenkarzinoms von entscheidender Bedeutung. Dabei wird mit einer Schablone in kurzer Zeit nach möglichen und im Krankheitszusammenhang relevanten Genveränderungen geschaut. Innerhalb kürzester Zeit (ca. fünf Tage) können genetische Veränderungen in Tumorgeweben untersucht werden. Mit konventioneller Sequenzierung würde dies viele Wochen bis sogar Monate dauern.
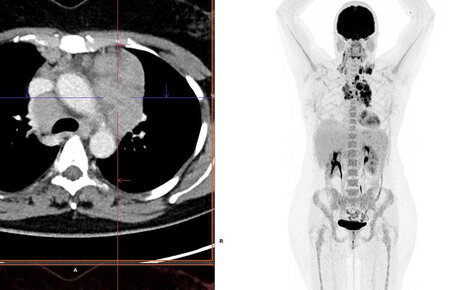
Aufnahme eines PET/CT
Die PET/CT ist eine Kombination aus zwei bildgebenden Untersuchungsverfahren: der Positronen Emissions Tomographie (PET) (ein nuklearmedizinisches Verfahren) und der Computertomographie (CT).
Im Rahmen der PET wird intravenös eine schwach radioaktive Substanz verabreicht. Diese markiert Stoffwechselvorgänge, welche durch eine PET-Kamera sichtbar gemacht werden und in ihrer Aktivität beurteilt werden können. In Verbindung mit der CT können anatomische und gleichzeitig metabolische (stoffwechselbezogene) Zusammenhänge dargestellt werden, die für Tumore aber auch Entzündungen im Körper typisch sind.
Therapieformen
Medikamentöse Tumortherapien werden zumeist in Intervallen, sogenannten Zyklen, durchgeführt. Auf eine Behandlungsphase folgt eine Behandlungspause. In regelmäßigen Abständen werden Verlaufskontrollen durchgeführt, um das „Ansprechen“ der Therapie zu beurteilen.
Die Chemotherapie stellt neben der Operation und Strahlentherapie eine zentrale Säule in der Behandlung von Krebserkrankungen dar. Es werden sogenannte Zytostatika eingesetzt, um Krebszellen abzutöten oder deren Vermehrung zu stoppen. Die Chemotherapie kann dabei allein oder auch kombiniert mit anderen Behandlungen wie Strahlentherapie oder Immuntherapie eingesetzt werden. „Neoadjuvante“ Therapien sollen vor einer Operation die Tumormasse verringern. Eine „adjuvante“ Behandlung erfolgt nach einer Operation, um ggf. mikroskopisch kleine verbliebene Tumorzellen abzutöten.

Markus Scholz
Markus Scholz
Seit mehr als 20 Jahren wird am Klinikum Ernst von Bergmann die hochdosierte Chemotherapie mit anschließender autologer Blutstammzelltransplantation erfolgreich zur Behandlung von bösartigen hämatologischen Erkrankungen eingesetzt. Mitunter gibt es zwischenzeitlich neue Therapieoptionen für Patient*innen mit Lymphomen und Multiplem Myelom. Dennoch gilt die Hochdosis-Chemotherapie mit anschließender autologer Stammzelltransplantation weiterhin als etablierteste und anerkannte Behandlung und zählt somit zu den erfolgreichsten und aussichtsreichsten Therapiemethoden.
Nach Behandlung einer Krebserkrankung bleiben unter Umständen noch Resttumorzellen zurück. Diese können durch eine Hochdosischemotherapie endgültig zerstört werden. Hierdurch wird jedoch auch das Knochenmark fast komplett zerstört. Lebensnotwendige Blutzellen können dann nicht mehr vom Körper selbst ausreichend gebildet werden. Hilfestellung geben dann körpereigene Blutstammzellen, die den Patient*innen vor der Hochdosis-Chemotherapie entnommen werden. Diese werden zwischenzeitlich tiefgefroren und für die Rückübertragung als Infusion wieder aufbereitet. Diese Zellen sollen dann wieder die eigene Blutbildung übernehmen. Da es sich hierbei um die eigenen Stammzellen der Patient*innen handelt, nennt man das Vorgehen autologe Stammzelltherapie, abgeleitet aus dem Griechischen „auto“, das bedeutet „selbst". Die autologe Stammzelltransplantation ist somit keine Behandlung der Krebserkrankung, sondern ermöglicht die Durchführung der Hochdosis-Therapie. Da bei der autologen Stammzelltherapie körpereigene Stammzellen der Patient*in übertragen werden, treten nur in äußerst seltenen Einzelfällen eine Abstoßungsreaktionen wie bei der allogenen Stammzelltransplantation (Übertragung von Blutstammzellen eines fremden Spenders) auf.
Das eigene Immunsystem wird zur Krebsbekämpfung benötigt und zielgerichtet eingesetzt: Die Immunonkologie setzt an sogenannten Check-Points (Kontrollpunkten) an. Diese befinden sich auf den T-Zellen (Untergruppe der weißen Blutzellen) und verhindern normalerweise eine Überreaktion des Immunsystems. Tumorzellen können jedoch diese Checkpoints ebenfalls besetzen und somit die eigentlich gegen sie gerichtete Immunantwort verhindern. Checkpoint-Inhibitoren lösen die Blockade durch die Krebszelle an diesen Kontrollpunkten wieder auf und regen damit das Immunsystem der Patient*innen zur Erkennung und Vernichtung der Tumorzellen an.
Die sog. „targeted therapy“ greift gezielt in die Vorgänge der Tumorzelle ein, die für das Wachstum oder den Stoffwechsel der Tumorzelle von Bedeutung sind. Vor dem Einsatz von zielgerichteten Therapien werden die speziellen Eigenschaften der Tumorzellen und die Zielstrukturen der Wirkstoffe (targets) untersucht. Die zielgerichtete Therapien werden als Infusionen oder häufiger als Tabletten verabreicht.
Hormonsensitive Tumore wachsen unter dem Einfluss von Hormonen. Die endokrine Therapie macht sich diese Abhängigkeit der Krebszellen zu Nutze und unterdrückt die Hormonwirkung, z.B. Antiöstrogene bei Brustkrebs oder eine antihormonelle Behandlung beim Prostata-Karzinom und bei Neuroendokrinen Tumoren.
Ein Mangel von Blut oder Blutbestandteilen wird mittels einer Bluttransfusion oder Thrombozytentransfusion ausgeglichen. Im Falle von Blutgerinnungsstörungen können Plasma- oder Blutgerinnungsfaktoren gezielt verabreicht werden.
Supportive Therapie
Die Forschung und Entwicklung neuer Therapien und Medikamente für Krebspatient*innen schreiten rasant voran. Leider sind damit auch Nebenwirkungen verbunden, die jedoch durch eine entsprechende Behandlung der Begleiterkrankungen (supportive Therapie) vermindert oder sogar verhindert werden können. Somit ermöglicht die Supportivtherapie, dass die Patientin / der Patient seine wichtige Krebsbehandlung kontinuierlich fortsetzen kann. Eine optimale supportive Therapie bildet daher einen maßgeblichen Schwerpunkt unserer Arbeit. Wir setzen dabei die Inhalte der S3 Leitlinie Supportive Therapie bei onkologischen PatientInnen mit dem Ziel einer bestmöglichen Lebensqualität – in der aktiven Therapiephase und auch in der palliativen Situation in unserer täglichen Arbeit mit dem Patient*innen um. Diese S3 Leitlinie, die die supportive Therapie in Deutschland maßgeblich definiert, wird von Frau Prof. Jordan bereits zum 2. Mal zusammen mit Frau Dr. Jahn von der Universitätsklinik Halle koordiniert.
Ein Kernstück der Supportiv-Leitlinie ist die korrekte praktische Umsetzung der supportiven Maßnahmen bei der Krebsbehandlung im klinischen Alltag. In unserem digitalen Chemotherapie-Protokollsystem sind diese datengestützten und von Experten erarbeiteten Behandlungspfade bereits digital verankert und werden individuell auf die Patientin/den Patienten zugeschnitten begleitend angewandt. Dieses Vorgehen ermöglicht eine maximale Minimierung von Nebenwirkungen und bahnt ein rasches und adäquates Einschreiten bei Problemen und Unverträglichkeiten.
Weitere wichtige Informationen über mögliche Nebenwirkungen erhalten Sie in der Patientenleitlinie Supportive Therapie – Vorbeugung und Behandlung von Nebenwirkungen einer Krebsbehandlung.
Mögliche Nebenwirkungen (Auswahl)
Chemotherapie, Bestrahlung oder auch die Krebserkrankung selbst können eine Blutarmut – einen Mangel an roten Blutzellen (Erythrozyten) – hervorrufen. Der Körper wird dadurch mit weniger Sauerstoff versorgt. Betroffene sind oft müde, erschöpft und weniger leistungsfähig. Eine Blutarmut kann mit blutbildenden Wirkstoffen während der Chemotherapie (sog. Erythropoese-stimulierende Wirkstoffe – kurz ESA – regen die Bildung roter Blutzellen im Knochenmark an), ggf. zusammen mit Eisen oder Blutübertragung (Bluttransfusion) behandelt werden. Sollte z.B. ein Vitamin B12 oder Folsäure Mangel ursächlich für die Blutarmut sein, ersetzen wir diesen.
Bestimmte weiße Blutzellen, die sogenannten neutrophilen Granulozyten, sind wichtig für das körpereigene Abwehrsystem. Zytostatika können die Anzahl der weißen Blutzellen verringern, da sie neben den Krebszellen leider auch gesunde Zellen, wie die blutbildenden Zellen des Knochenmarks, abtöten. Ein Mangel an neutrophilen Granulozyten, eine sogenannte „Neutropenie“ schwächt das Abwehrsystem und macht die Patientin/ den Patienten anfälliger für eine Infektion. Um einer Neutropenie vorzubeugen, können - wenn indiziert - „Granulozyten-Wachstumsfaktoren“ (kurz: G-CSF) eingesetzt werden. Diese fördern die Bildung der weißen Blutzellen – der Granulozyten – im Knochenmark.
Als Folge einer Krebsbehandlung mit Medikamenten oder durch eine Bestrahlung im Bereich von Kopf und Hals kann sich die empfindliche Schleimhaut von Mund und Rachen entzünden. Der Fachbegriff dafür lautet „orale Mukositis“. Patient*innen mit einer Krebsbehandlung, die die Mundschleimhaut schädigen kann, sollen Empfehlungen zur allgemeinen Mundpflege, wie z.B. gründliche Zahnhygiene, Mundspülungen mit Wasser oder Kochsalzlösung, Verzicht auf Tabak und Alkohol sowie die Führung eines Mundpflege Protokolls beachten. Kältebehandlungen können vor Mukositis schützen, wenn das Krebsmedikament 5-Fluorouracil als Spritze oder Melphalan hochdosiert zum Einsatz kommt. Um die Schmerzen bei Mukositis zu lindern, kommen zunächst die üblichen Schmerzmedikamente zum Einsatz.
Übelkeit und Erbrechen können belastende Nebenwirkungen einer Tumorbehandlung oder Bestrahlung sein. Ob und wie stark die Beschwerden auftreten, hängt von der Art der eingesetzten Krebsmedikamente beziehungsweise von Gebiet und Dosis der Bestrahlung ab. Bereits vor Beginn der Behandlung werden sogenannte „Antiemetika“ verabreicht, um diese Nebenwirkungen möglichst vollständig zu verhindern.
In Folge einer Krebsbehandlung kann es zu unerwünschten Hautreaktionen kommen, auch Haare und Nägel können betroffen sein. Die Veränderungen an Haut, Haaren und Nägeln sind für manche Patient*innen sehr belastend. Betroffene sollten das Behandlungsteam informieren, sobald Hautveränderungen auftreten.
Das „Hand-Fuß-Syndrom“ z.B. bezeichnet eine schmerzhafte Rötung und eine Schwellung an den Handinnenflächen und Fußsohlen. Vermeiden Sie möglichst Hitze, Druck und Reibung auf Händen und Füssen, z.B. durch das Tragen zu enger Schuhe. Zusätzlich sollten Sie Ihre Hände und Füße mehrfach täglich mit Cremes pflegen, die 5 bis 10 % Harnstoff (Urea) enthalten. Bei einer Behandlung mit Docetaxel kann Ihnen empfohlen werden, die Hände und Füße zu kühlen. Bei schwerem Verlauf sollten nach Expertenmeinung zusätzlich kortikoidhaltige Medikamente auf betroffene Hautstellen aufgetragen werden.
Tumortherapie-induzierte Diarrhoe ist eine häufige, die Patient*innen belastende und gefährliche Nebenwirkung. Neben klassischen Chemotherapeutika verursachen auch die zielgerichteten neuen Substanzen wie Antikörper und Tyrosinkinaseinhibitoren mitunter Diarrhoen. Durch effektive supportive Therapiemöglichkeiten wird nicht nur die Lebensqualität der betroffenen Patient*innen verbessert, sondern auch maßgeblich der Erfolg der Tumortherapie durch Verhinderung von Therapieverzögerungen bzw. -abbrüchen gefördert.
Immuncheckpoint-Inhibitoren (ICIs) werden mittlerweile bei vielen verschiedenen Tumorentitäten aus dem Bereich der soliden und der hämatologischen Tumoren eingesetzt. ICIs induzieren oder begünstigen aufgrund ihres Wirkmechanismus häufig autoimmune Nebenwirkungen, die prinzipiell jedes Organsystem betreffen können und teilweise bekannten Autoimmunerkrankungen (Autoimmunopathien) ähneln. Diese Nebenwirkungen müssen früh erkannt und behandelt werden.
Komplikationen im Bereich des Knochenskelettes sind häufige, für die Patient*innen äußerst belastende Ereignisse verursacht durch den Tumor selbst oder auch bedingt durch die Tumortherapie. Hierzu gehören einerseits die Therapie-induzierte Osteoporose in Folge bestimmter Hormontherapien und andererseits das breite klinische Bild der ossären Metastasen. Das Risiko schwerer schmerzhafter Komplikationen wie pathologischer Frakturen oder spinaler Kompressionssyndrome erfordern eine frühzeitige Abwägung und Initiierung der geeigneten Intervention. Hier stehen interdisziplinär chirurgische, strahlentherapeutische und medikamentöse Maßnahmen zur Verfügung.